Первая таргетная адъювантная терапия АЛК+ НМРЛ
Адъювантное лечение ALK+ немелкоклеточного рака лёгкого (НМРЛ)
Алектиниб обеспечил превосходную выживаемость без прогрессирования (ВБП) по сравнению с химиотерапией1

Клиническое исследование Алектиниба ALINA
Рандомизированное, многоцентровое, открытое исследование III фазы у пациентов с резецированным ALK+ НМРЛ стадии IB–IIIA1,3

aРандомизация проводилась с учетом расы (азиатская и другие расы) и стадии заболевания (IB, II и IIIA). Факторы стратификации были применены для анализа коэффициента риска и P-значения (с учетом расы для стадии II–IIIA, с учетом расы и стадии для стадии IB–IIIA)¹.
bПри рецидиве заболевания пациенты в группе химиотерапии могли получать Алектиниб по усмотрению исследователя3.

Основные критерии включения3,4
- Возраст ≥18 лет
- Подтвержденный ALK+ статус с использованием теста, одобренного FDA
- ECOG PS 0–1
- Достаточная функция жизненно важных органов
- Возможность получать химиотерапию на основе платины

Выбранные конечные точки3,4
- Первичная: выживаемость без признаков заболевания по оценке исследователя
- Вторичная: общая выживаемость
- Исследовательская: выживаемость без признаков заболевания в ЦНС
Исходные характеристики пациентов3
| Характеристики пациентов | Алектиниб (n=130) | Химиотерапия (n=127) |
Возраст, лет
| Медиана | 54 | 57 |
| 103 (79%) | 93 (73%) | |
| ≥65, n (%) | 27 (21%) | 34 (27%) |
Пол, n (%)
| Женщины | 75 (58%) | 59 (47%) |
| Мужчины | 55 (42%) | 68 (53%) |
Раса, n (%)
| Азиатская | 72 (55%) | 71 (56%) |
| Африканская | 1 (1%) | 0 |
| Белая | 55 (42%) | 52 (41%) |
| Неизвестно | 2 (2%) | 4 (3%) |
Этническая принадлежность, n (%)
| Испаноязычные/латиноамериканцы | 1 (1%) | 0 |
| Не испаноязычные/латиноамериканцы | 127 (97%) | 122 (96%) |
| Не указано | 2 (2%) | 2 (2%) |
| Неизвестно | 0 | 3 (2%) |
ECOG PS, n (%)
| 0 | 72 (55%) | 65 (51%) |
| 1 | 58 (45%) | 62 (49%) |
Курение, n (%)
| В настоящем | 5 (4%) | 3 (2%) |
| В прошлом | 41 (31%) | 54 (43%) |
| Никогда | 84 (65%) | 70 (55%) |
Стадия первичного диагноза по
7-му изданию AJCC, n (%)
| Стадия IB | 14 (11%) | 12 (9%) |
| Стадия II | 47 (36%) | 45 (35%) |
| Стадия IIIA | 69 (53%) | 70 (55%) |
Гистология, n (%)
| Плоскоклеточный | 6 (5%) | 3 (2%) |
| Неплоскоклеточный | 124 (95%) | 124 (98%) |
Хирургическое вмешательство, n (%)
| Лобэктомия | 126 (97%) | 117 (92%) |
| Другое | 4 (3%)a | 10 (8%)b |
Стадия поражения регионарных
лимфатических узлов, n (%)
| N0 | 21 (16%) | 18 (14%) |
| N1 | 45 (35%) | 43 (34%) |
| N2 | 64 (49%) | 66 (52%) |
ECOG PS — статус состояния Восточной кооперативной онкологической группы; FDA — Управление по контролю за продуктами и лекарствами США.
aВключает манжеточную лобэктомию (n=0), билобэктомию (n=2) и пневмонэктомию (n=2).
bВключает манжеточную лобэктомию (n=1), билобэктомию (n=5) и пневмонэктомию (n=4).
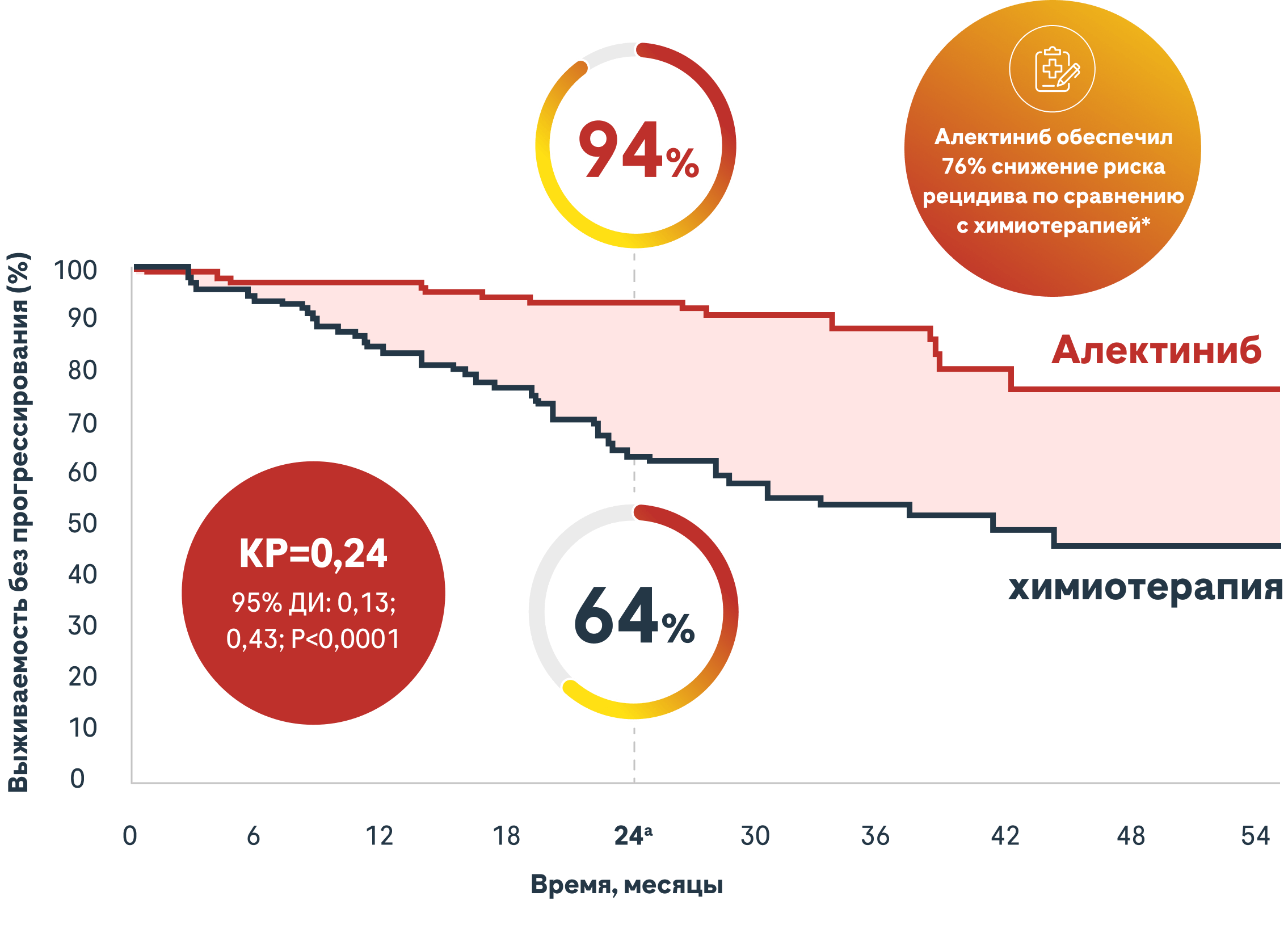
При резектабельном ALK+ НМРЛ Алектиниб обеспечил превосходную выживаемость без признаков заболевания по сравнению с химиотерапией1,3
Число в группе риска
aAлектиниб 95% ДИ: 89,4, 97,9; химиотерапия 95% ДИ: 54,6, 72,9.

В популяции ITT (стадия IB-IIIA† НМРЛ) медиана ВБП не была достигнута для Алектиниба (95% ДИ: NE, NE) по сравнению с 41,3 месяцами (95% ДИ: 28,5, NE) для химиотерапии (КР=0,24 [95% ДИ: 0,13; 0,43] P<0,0001)1

Медианная выживаемость после наблюдения: Алектиниб: 27,8 месяцев; химиотерапия: 28,4 месяца3
Анализы знаковых событий не были рассчитаны на демонстрацию статистически значимых различий, и на основе этих анализов нельзя сделать никаких выводов. Двухлетняя скорость безрецидивной выживаемости считается заранее определенной исследовательской конечной точкой.
*Определяется как возникновение любого из следующих событий: рецидив заболевания, новый первичный НМРЛ или смерть по любой причине1.
†Согласно системе стадирования UICC/AJCC, 7-е издание1.
Предварительно запланированные исследовательские анализы
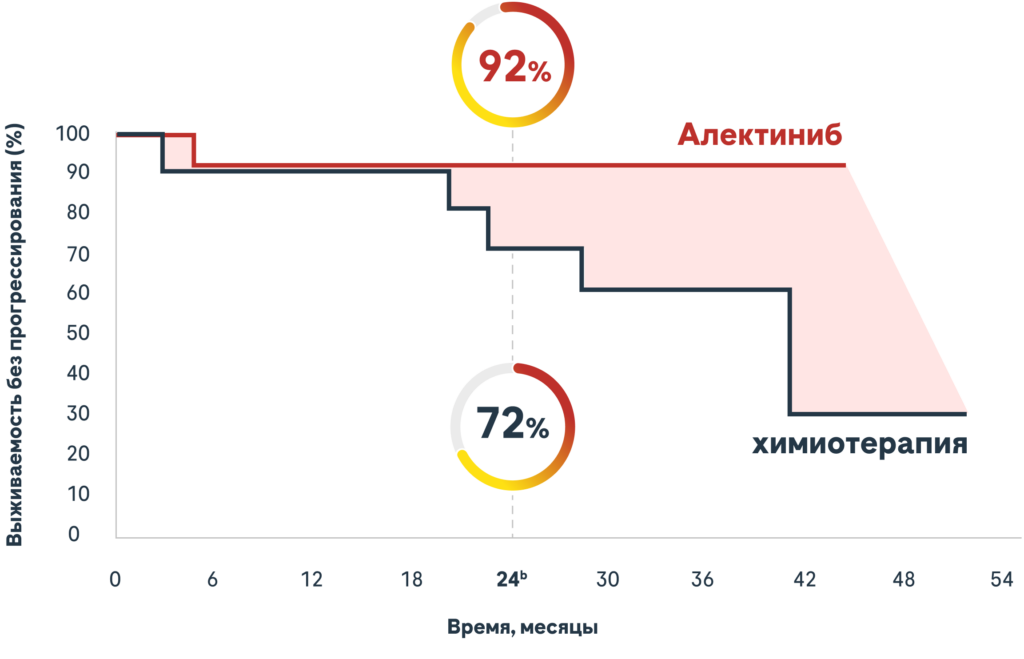
Aлектиниб показал стабильную ВБП на разных стадиях НМРЛ3,5
| Стадия IBa КР=0,21 (95% ДИ: 0,02, 1,84) | Стадия IIa КР=0,24 (95% ДИ: 0,09, 0,65) | Стадия IIIAa КР=0,25 (95% ДИ: 0,12, 0,53) |
Число в группе риска
aСогласно системе стадирования UICC/AJCC, 7-е издание.
bAлектиниб 95% ДИ: 77,8; 100,0; химиотерапия 95% ДИ: 44,2; 98,9.
Эти анализы подгрупп были разведочными и не были рассчитаны на демонстрацию статистической значимости в группах лечения.
Анализы знаковых событий не были рассчитаны на демонстрацию статистически значимых различий, и на основе этих анализов нельзя сделать никаких выводов.
Уровень двухлетней ВБП считается заранее определенной конечной точкой.
При терапии Алектинибом наблюдалось 78% снижение риска рецидива ЦНС3*
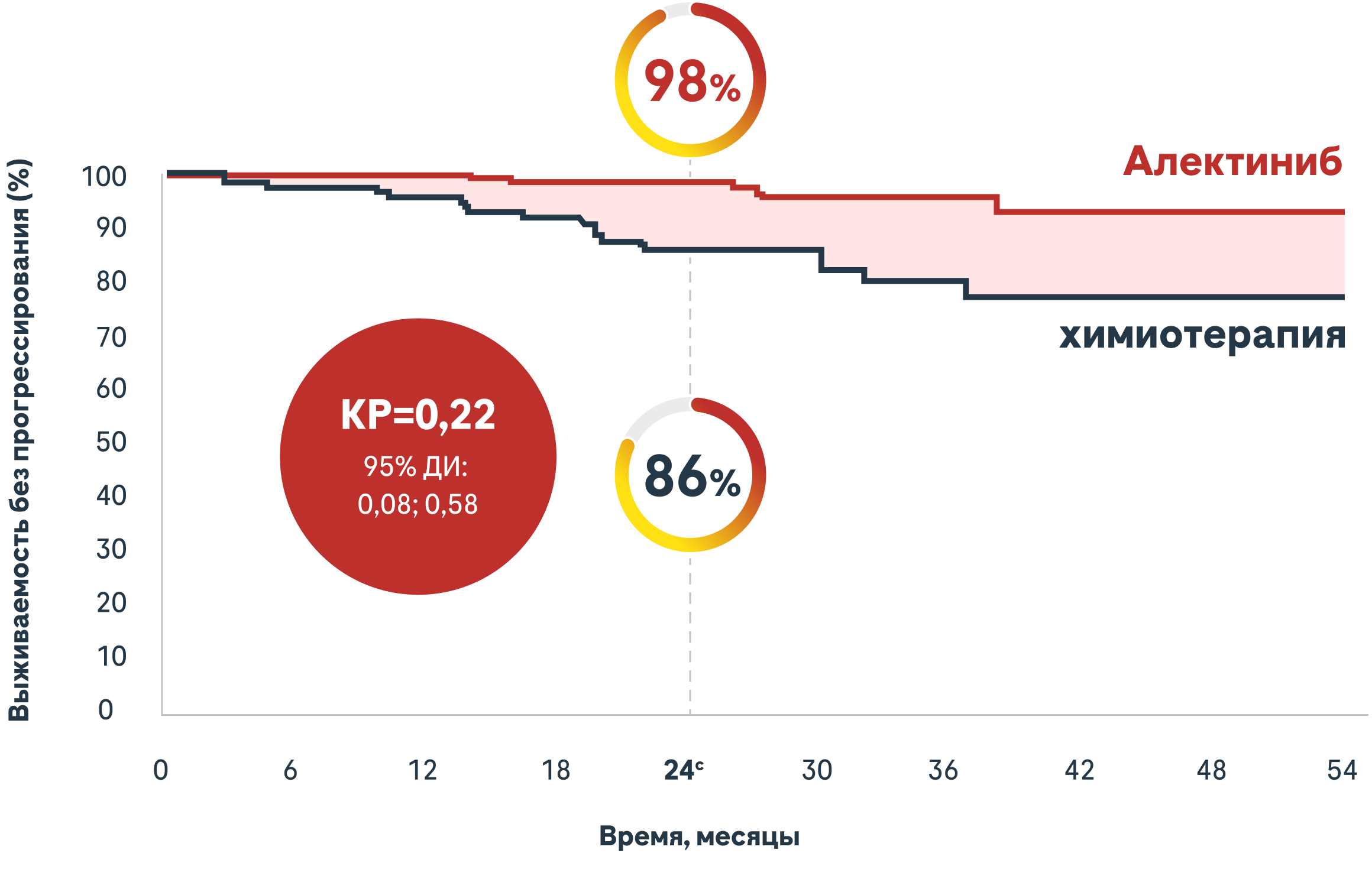
Число в группе риска
cAлектиниб 95% ДИ: 96,11; 100,0; химиотерапия 95% ДИ: 78,83; 92,82.
В исследовательском анализе по местам рецидивов было 4 пациента (3,1%) в группе Aлектиниба и 14 пациентов (11,0%) в группе химиотерапии с вовлечением головного мозга1.
Анализы на ключевых временных точках не имели статистической мощности для выявления значимых различий, и выводы на основе этих анализов делать нельзя.
Двухлетний уровень ВБП считается заранее определённой исследовательской конечной точкой.
*Определяется как возникновение любого из следующих событий: рецидив в ЦНС или смерть от любой причины3.
AJCC — Американский объединенный комитет по борьбе с раком; ALK — киназа анапластической лимфомы; ДИ — доверительный интервал;
ЦНС — центральная нервная система; ВБП — выживаемость без прогрессирования; КР — коэффициент риска; ITT — намерение лечить;
НМРЛ — немелкоклеточный рак лёгкого; ИТК — ингибитор тирозинкиназы; UICC — Международный союз по борьбе с раком; NE — не поддается оценке.
Источники
- ОХЛП Алеценза, 150 мг. Приказ № N081413 от 22 ноября 2024 г.
- Referenced with permission from the NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Non-Small Cell Lung Cancer V.10.2024. © National Comprehensive Cancer Network, Inc. 2024. All rights reserved. Accessed September 24, 2024. To view the most recent and complete version of the guideline, go online to NCCN.org. NCCN makes no warranties of any kind whatsoever regarding their content, use, or application, and disclaims any responsibility for their application or use in any way. See the NCCN Guidelines® for detailed recommendations.
- Wu YL, Dziadziuszko R, Ahn JS, et al. Alectinib in resected ALK-positive non-small-cell lung cancer. N Engl J Med. 2024;390(14):1265-1276. doi:10.1056/NEJMoa2310532.
- A study comparing adjuvant alectinib versus adjuvant platinum-based chemotherapy in patients with ALK positive non-small cell lung cancer. ClinicalTrials.gov identifier: NCT03456076. https://clinicaltrials.gov/study/NCT03456076. Updated December 13, 2023. Accessed December 15, 2023.
- Wu YL, Dziadziuszko R, Ahn JS, et al. Alectinib in resected ALK-positive non–small-cell lung cancer. N Engl J Med. 2024;390(14)(suppl):1265-1276. doi:10.1056/NEJMoa2310532.
