Немелкоклеточный рак легкого на ранней стадии с высоким уровнем PDL-1
Рекомендации NCCN
Категория 2А,
Рекомендуемый вариант
Добавление Атезолизумаба после химиотерапии является рекомендуемым вариантом иммунотерапии (категория NCCN 2A) для адъювантного лечения пациентов с полностью резецированным НМРЛ стадии IIB-IIIA, стадии IIIB (T3, N2) или НМРЛ стадии IIA высокого риска с PD-L1 ≥1% в соответствии с данными NCCN®4§¶@
Ключевое исследование III фазы IMpower010 показало, что Атезолизумаб в качестве адъювантной терапии обеспечил 34% снижение риска рецидива по сравнению с лучшей поддерживающей терапией (ЛПТ) (КР=0,66#; 95% ДИ, 0,50-0,88; P=0,004); медиана наблюдения 32,8 месяца1,2

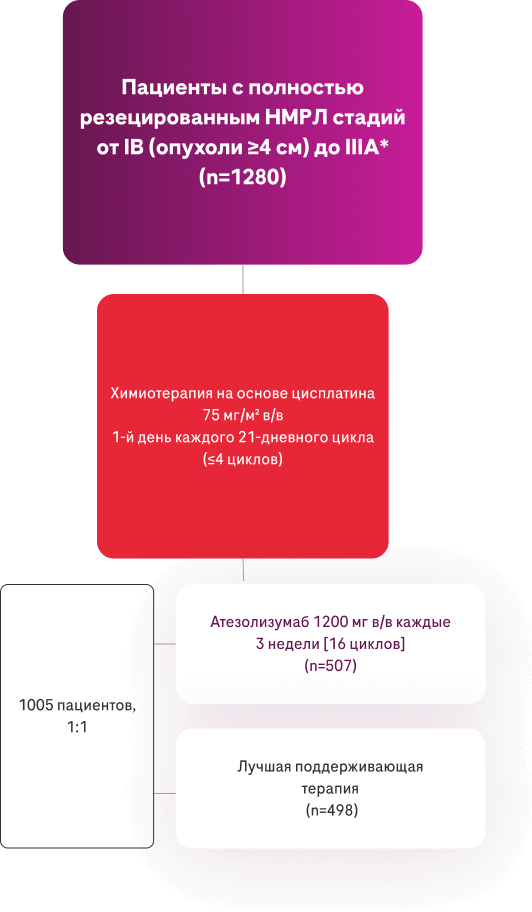
* IMpower010 — многоцентровое, международное, рандомизированное (1:1), открытое исследование III фазы у пациентов с полностью резецированным немелкоклеточным раком лёгкого (НМРЛ) стадии IB-IIIA1,2.

Основная конечная точка1,2
- Оценка выживаемости без прогрессирования (ВБП)

Выбранные вторичные конечные точки1,2
- Общая выживаемость (OВ) в популяции по принципу намерения лечить (ITT)
- Показатели выживаемости без прогрессирования через
3 и 5 лет
Исходные характеристики популяции с PD-L1+ НМРЛ (TC ≥1%) стадии II-IIIA2
| Характеристики пациентов | Атезолизумаб (n=248) | ЛПТ (n=228) |
Демография пациентов
| Возраст, медиана, года | 61 (56-67) | 62 (56-68) |
| Возраст ≥65 лет, % | 37 | 43 |
| Мужчины, % | 69 | 64 |
Раса, %
| Белая | 65 | 73 |
| Азиатская | 31 | 25 |
«История курения», %
| Никогда | 21 | 18 |
| Текущий/Предыдущий | 79 | 82 |
Гистология, %
| Неплоскоклеточный | 61 | 63 |
| Плоскоклеточный | 39 | 37 |
Стадия, %
| IIА | 34 | 33 |
| IIВ | 19 | 16 |
| IIIА | 47 | 50 |
Тип операции, %
| Лобэктомия | 75 | 76 |
| Другие† | 25 | 24 |
ECOG PS, %‡
| 0 | 56 | 55 |
| 1 | 43 | 45 |
Наличие EFGR-мутации, %
| Да | 9 | 9 |
| Нет | 50 | 55 |
| Неизвестно | 41 | 36 |
Наличие перестройки ALK, %
| Да | 5 | 5 |
| Нет | 54 | 53 |
| Неизвестно | 42 | 42 |
Статус экспрессии PD-L1, %
| TC ≥50% | 46 | 50 |
| TC 1%-49% | 54 | 50 |
ALK = киназа анапластической лимфомы; ECOG = Восточная кооперативная онкологическая группа; EGFR = рецептор эпидермального фактора роста; PD-L1 = лиганд программируемой клеточной смерти 1; PS = статус работоспособности; TC = опухолевые клетки; ЛПТ = лучшая поддерживающая терапия.
† Рукавная лобэктомия, билобэктомия, пневмонэктомия и другие виды хирургических вмешательств.
‡ У 2 пациентов PS по шкале ECOG составил 2.
Выживаемость без прогрессирования (ВБП)
При первичном анализе ВБП было продемонстрировано снижение риска рецидива на 34% при использовании Атезолизумаба по сравнению с лучшей поддерживающей терапией (ЛПТ) при PD-L1+ НМРЛ стадии II-IIIA1,21,2
Медиана ВБП, месяцы
| Атезолизумаб (n=507) | ЛПТ (n=498) | Снижение риска рецидива |
| НЕ ДОСТИГНУТА (95% ДИ, 36,1 -NE) | 35,3 (95% ДИ, 29,0-NE) | 34% КР=0,66# (95% ДИ, 0,50-0,88; р=0,004) |
- Медиана наблюдения: 32,8 месяца
При окончательном анализе ВБП: медиана ВБП при терапии Атезолизумабом оказалась в два раза выше, чем при ЛПТ3
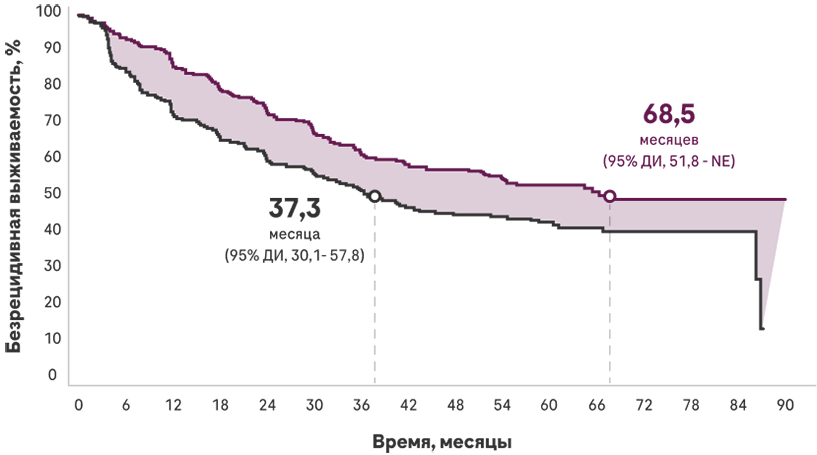

Число в группе риска

- Медиана наблюдения: 65,2 месяца
Исследовательский анализ общей выживаемости (OВ) Атезолизумаба в IMpower010
На протяжении более 5 лет наблюдения было отмечено снижение риска смерти на 23% при терапии Атезолизумабом по сравнению с ЛПТ, сохраняющееся при втором промежуточном анализе общей выживаемости.
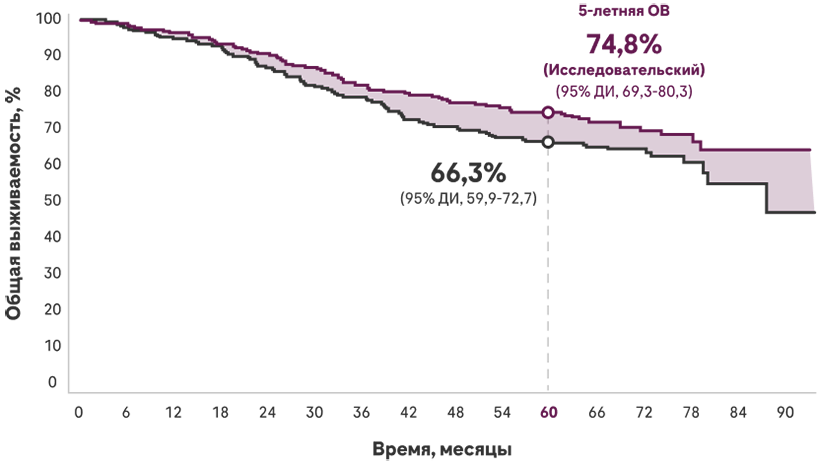

Число в группе риска
- Медиана наблюдения: 65,2 месяца.
- Это был исследовательский анализ пациентов с PD-L1+ НМРЛ стадий II-IIIA второго из 5 предварительно определенных анализов OВ и носит описательный характер; следовательно, P-значение не может быть официально заявлено.
Атезолизумаб стал первым иммунопрепаратом, для которого были опубликованы данные о выживаемости более 5 лет при адъювантной терапии НМРЛ.
NCCN = Национальная всеобъемлющая онкологическая сеть® (NCCN®); ALK = киназа анапластической лимфомы; EGFR = рецептор эпидермального фактора роста; ЛПТ = лучшая поддерживающая терапия; ТГСК = трансплантация гемопоэтических стволовых клеток; ДИ = доверительный интервал; КР = коэффициент риска;
ITT = намерение лечить; WT = дикий тип; мНМРЛ = метастатический немелкоклеточный рак лёгких; nsq = неплоскоклеточный; sq = плоскоклеточный; OВ = общая выживаемость; PD-L1 = лиганд запрограммированной клеточной смерти 1; ВБП = выживаемость без прогрессирования; RECIST = критерии оценки ответа при солидных опухолях; TC = опухолевые клетки; IC = иммунные клетки, инфильтрирующие опухоль; УОО = уровень объективного ответа; ECOG = Восточная кооперативная онкологическая группа; PS = статус работоспособности; в/в = внутривенно; NE = не поддается оценке.
# Стратифицировано по стадии заболевания, полу и гистологии.
† Формальное тестирование гипотез для этих подгрупп не проводилось.
‡ Приведены нестратифицированные значения КР.
! Сообщаются стратифицированные КР. Учитывая иерархическую структуру IMpower010, результаты ОВ в настоящее время не могут быть официально проверены.
§ Категория 2A: на основе доказательств более низкого уровня существует единое мнение NCCN о том, что вмешательство является целесообразным.
¶ Для пациентов без противопоказаний к ингибиторам иммунных контрольных точек и без делеции экзона 19 EGFR или мутаций L858R экзона 21 или перестроек ALK.
@ В версии 5.2024 Руководства по клинической практике NCCN в онкологии (Руководства NCCN®) для НМРЛ используется Руководство AJCC по стадированию рака, 8-е издание. NCCN не дает никаких гарантий относительно их содержания, использования или применения и отказывается от любой ответственности за их применение или использование каким-либо образом. Подробные рекомендации см. в Руководстве NCCN®. Руководство NCCN® для НМРЛ содержит рекомендации по определенным отдельным биомаркерам, которые следует тестировать, и рекомендует методы тестирования, но не одобряет какие-либо конкретные коммерчески доступные анализы биомаркеров или коммерческие лаборатории.
Источники
- ОХЛП Тецентрик, 1200 мг/20 мл. Приказ № N069768 от 07 декабря 2023 г.
- Felip E, Altorki N, Zhou C, et al; IMpower010 Investigators. Adjuvant atezolizumab after adjuvant chemotherapy in resected stage IB-IIIA non-small-cell lung cancer (IMpower010): a randomised, multicentre, open-label, phase 3 trial. Lancet. 2021;398:1344 -1357.
- Wakelee H, Altorki N, Zhou C, et al. IMpower010: final disease-free survival (DFS) and second overall survival (OS) interim results after ≥5 years of follow up of a phase III study of adjuvant atezolizumab vs best supportive care in resected stage IB-IIIA non-small cell lung cancer (NSCLC). Presented at: Annual Meeting of the American Society of Clinical Oncology; May 31-June 4, 2024; Chicago, Illinois.
- Referenced with permission from the NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Non-Small Cell Lung Cancer V.5.2024. © National Comprehensive Cancer Network, Inc. 2023. All rights reserved. Accessed April 23, 2024. To view the most recent and complete version of the guideline, go online to www.NCCN.org.
